
por David | Abr 10, 2023 | BIOMEDICO
Investigadores de la Ecole Polytechique Federale de Lausanne han combinado los campos del diseño de chips de bajo consumo, los algoritmos de aprendizaje automático y los electrodos blandos implantables para crear una interfaz neuronal capaz de identificar y mitigar los síntomas de diversos trastornos neurológicos.
Mahsa Shoaran, del Laboratorio de Neurotecnologías Integradas de la Facultad de Ingeniería, trabajó junto con Stéphanie Lacour del Laboratorio de Interfaces Bioelectrónicas Suaves para crear NeuralTree, un sistema de neuromodulación de ciclo cerrado en un chip que es capaz de detectar y aliviar los síntomas de la enfermedad.
El sistema cuenta con una matriz de detección de alta resolución de 256 canales y un procesador de aprendizaje automático de bajo consumo, lo que le permite extraer y categorizar de manera efectiva una amplia gama de biomarcadores a partir de datos de pacientes reales y modelos de enfermedades animales in vivo. Esto da como resultado un alto nivel de precisión en la predicción de síntomas.
NeuralTree funciona mediante la extracción de biomarcadores neuronales (patrones de señales eléctricas que se sabe que están asociados con ciertos trastornos neurológicos) de las ondas cerebrales. Luego clasifica las señales e indica si anuncian un ataque epiléptico inminente o un temblor parkinsoniano, por ejemplo, si se detecta un síntoma, se activa un neuroestimulador, también ubicado en el chip, que envía un pulso eléctrico para bloquearlo.
Shoaran explica que el diseño único de NeuralTree le da al sistema un grado de eficiencia y versatilidad sin precedentes en comparación con los sistemas de última generación. El chip cuenta con 256 canales de entrada, en comparación con los 32 de los dispositivos integrados de aprendizaje automático anteriores, lo que permite procesar más datos de alta resolución en el implante. El diseño de área eficiente del chip significa que también es extremadamente pequeño (3,48 mm2), lo que le otorga un gran potencial de escalabilidad a más canales. La integración de un algoritmo de aprendizaje ‘consciente de la energía’, que penaliza las funciones que consumen mucha energía, también hace que NeuralTree sea altamente eficiente en términos de energía.
Además de estas ventajas, el sistema puede detectar una gama más amplia de síntomas que otros dispositivos, que hasta ahora se han centrado principalmente en la detección de ataques epilépticos. El algoritmo de aprendizaje automático del chip se entrenó en conjuntos de datos de pacientes con epilepsia y enfermedad de Parkinson y clasificó con precisión las señales neuronales pregrabadas de ambas categorías.

por David | Abr 3, 2023 | BIOMEDICO
Investigadores de la Universidad Tecnológica de Sydney (UTS) han desarrollado un nuevo dispositivo que puede detectar y analizar células cancerosas a partir de muestras de sangre, lo que permite a los médicos evitar cirugías de biopsia invasivas y monitorear el progreso del tratamiento.
El cáncer es una de las principales causas de enfermedad y muerte en Australia, los pacientes con sospecha de cáncer en órganos como el hígado, el colon o el riñón, a menudo requieren cirugía para un diagnóstico definitivo.
Hacerse una biopsia puede causar molestias a los pacientes, así como un mayor riesgo de complicaciones debido a la cirugía y mayores costos, pero un diagnóstico de cáncer preciso es vital para un tratamiento efectivo.
“Manejar el cáncer a través de la evaluación de células tumorales en muestras de sangre es mucho menos invasivo que tomar biopsias de tejido. Permite a los médicos repetir las pruebas y monitorear la respuesta del paciente al tratamiento”, dijo el profesor Majid Warkiani de la Escuela de Ingeniería Biomédica de la UTS.
El dispositivo Static Droplet Microfluidic es capaz de detectar rápidamente las células tumorales circulantes que se han desprendido de un tumor primario y han entrado en el torrente sanguíneo. El dispositivo utiliza una firma metabólica única del cáncer para diferenciar las células tumorales de las células sanguíneas normales.
En la década de 1920, Otto Warburg descubrió que las células cancerosas consumen mucha glucosa y, por lo tanto, producen más lactato; Por lo que este dispositivo monitorea el aumento de lactato en células individuales utilizando tintes fluorescentes sensibles al pH que detectan la acidificación alrededor de las células.
Una sola célula tumoral puede existir entre miles de millones de células sanguíneas en solo un mililitro de sangre, por lo que es muy difícil de encontrar. La nueva tecnología de detección cuenta con 38.400 cámaras capaces de aislar y clasificar el número de células tumorales metabólicamente activas.
Una vez que las células tumorales se identifican con el dispositivo, pueden someterse a un análisis genético y molecular, lo que puede ayudar en el diagnóstico y clasificación del cáncer e informar planes de tratamiento personalizados.
Las células tumorales circulantes también son precursoras de la metástasis, donde el cáncer migra a órganos distantes, que es la causa del 90 % de las muertes asociadas al cáncer. El estudio de estas células puede proporcionar información sobre la biología de la metástasis del cáncer, lo que puede informar el desarrollo de nuevos tratamientos.
Las tecnologías de biopsia líquida existentes requieren mucho tiempo, son costosas y dependen de operadores calificados, lo que limita su aplicación en entornos clínicos.
Esta nueva tecnología está diseñada para integrarse en laboratorios clínicos y de investigación sin depender de equipos de alta gama y operadores capacitados. Esto permitirá a los médicos diagnosticar y controlar a los pacientes con cáncer de una manera práctica y rentable.

por David | Mar 20, 2023 | BIOMEDICO
Ingenieros del MIT y Caltech han demostrado un sensor ingerible cuya ubicación se puede monitorear a medida que se mueve a través del tracto digestivo, un avance que podría ayudar a los médicos a diagnosticar más fácilmente los trastornos de la motilidad gastrointestinal como el estreñimiento, la enfermedad por reflujo gastroesofágico y la gastroparesia.
El diminuto sensor funciona detectando un campo magnético producido por una bobina electromagnética ubicada fuera del cuerpo. La fuerza del campo varía con la distancia desde la bobina, por lo que la posición del sensor se puede calcular en función de su medición del campo magnético.
En el nuevo estudio, los investigadores demostraron que podían usar esta tecnología para rastrear el sensor a medida que se movía a través del tracto digestivo de animales grandes. Dicho dispositivo podría ofrecer una alternativa a procedimientos más invasivos, como la endoscopia, que se utilizan actualmente para diagnosticar trastornos de la motilidad.
Los trastornos de la motilidad GI, pueden ocurrir en cualquier parte del tracto digestivo, lo que provoca que los alimentos no se muevan a través del tracto. Por lo general, se diagnostican mediante estudios de imágenes nucleares o rayos X, o mediante la inserción de catéteres que contienen transductores de presión que detectan las contracciones del tracto GI.
Los investigadores del MIT y Caltech querían encontrar una alternativa que fuera menos invasiva y pudiera realizarse en el hogar del paciente. Su idea era desarrollar una cápsula que pudiera tragarse y luego enviar una señal que revelara dónde estaba en el tracto GI, lo que permitía a los médicos determinar qué parte del tracto estaba causando una desaceleración y determinar mejor cómo tratar la condición del paciente.
Para lograrlo, los investigadores aprovecharon el hecho de que el campo producido por una bobina electromagnética se vuelve más débil, de manera predecible, a medida que aumenta la distancia de la bobina. El sensor magnético que desarrollaron, que es lo suficientemente pequeño como para caber en una cápsula ingerible, mide el campo magnético circundante y usa esa información para calcular su distancia desde una bobina ubicada fuera del cuerpo.
Para señalar con precisión la ubicación de un dispositivo dentro del cuerpo, el sistema también incluye un segundo sensor que permanece fuera del cuerpo y actúa como punto de referencia. Este sensor podría pegarse a la piel y, al comparar la posición de este sensor con la posición del sensor dentro del cuerpo, los investigadores pueden calcular con precisión dónde se encuentra el sensor ingerible en el tracto gastrointestinal.
El sensor ingerible también incluye un transmisor inalámbrico que envía la medición del campo magnético a una computadora o teléfono inteligente cercano. La versión actual del sistema está diseñada para realizar una medición cada vez que recibe un disparador inalámbrico desde un teléfono inteligente, pero también se puede programar para realizar mediciones en intervalos específicos.
La versión actual del sensor puede detectar un campo magnético de bobinas electromagnéticas dentro de una distancia de 60 centímetros o menos. Los investigadores prevén que las bobinas podrían colocarse en la mochila o chaqueta del paciente, o incluso en la parte trasera de un inodoro, lo que permitiría que el sensor ingerible tome medidas siempre que esté dentro del alcance de las bobinas.
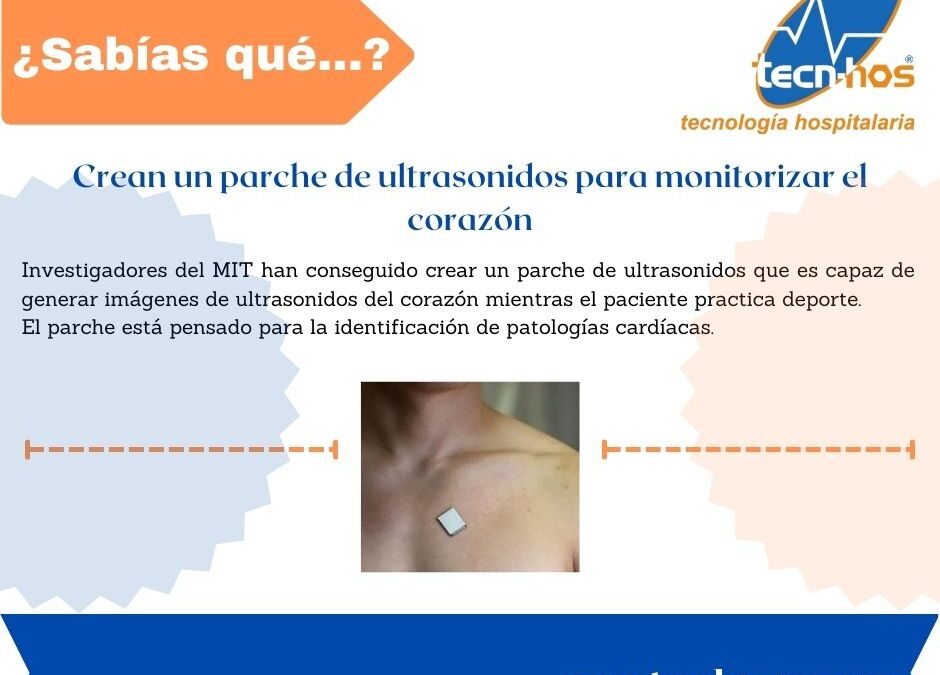
por David | Mar 13, 2023 | BIOMEDICO
Un grupo de investigadores del MIT ha conseguido crear un parche de ultrasonidos con un tamaño de 1.9 × 2.2 cm y un grosor de 0.9 mm que es capaz de generar imágenes de ultrasonidos del corazón mientras el paciente practica deporte.
Anteriormente otros investigadores estadounidenses construyeron un parche de mayores dimensiones que estaba pensado para su uso en reposo; sin embargo, este ha sido probado con éxito mientras los pacientes hacen ejercicio en una bicicleta estática.
El parche emplea un arreglo de sensores piezoeléctricos para enviar y recibir las ondas de ultrasonidos para generar continuamente imágenes del corazón.
El dispositivo es flexible, pudiéndose estirar hasta un 110% de su tamaño inicial, lo que quiere decir que se va a adaptar bastante bien a la piel del paciente.
El parche está pensado para la identificación de patologías cardíacas. Actualmente, aunque en una prueba de esfuerzo puede registrarse el electrocardiograma mientras el paciente hace ejercicio, las pruebas de imagen (ultrasonidos) se llevan a cabo antes y después del ejercicio, pero no durante el ejercicio.
No poder monitorizar el corazón durante el ejercicio podría hacer que se pierda información con valor diagnóstico.
El propósito de este parche es poder ver qué pasa con el corazón durante el ejercicio.

por David | Ago 12, 2022 | BIOMEDICO
La resistencia a los antibióticos es uno de los grandes problemas que preocupa a los científicos y que a largo plazo podría poner en riesgo a la humanidad, pero los llamados virus gigantes han llamado la atención de la ciencia por posiblemente ser la solución.
Estos virus caracterizados como bacteriófagos, han estado teniendo una lucha contra las bacterias desde mucho antes de que existiéramos, por lo que podrían tener la clave o por lo menos pistas para vencer a las bacterias resistentes a los antibióticos.
Por ello, investigadores de la Universidad de California en San Diego, Estados Unidos, analizaron más de cerca algunos de los fagos gigantes menos estudiados, específicamente 201phi2-1, que infecta a la bacteria Pseudomonas chlororaphis, reseña Science Alert.
Los fagos jumbo tienen un arsenal de técnicas para contrarrestar los mecanismos de defensa bacterianos, creando un escudo alrededor de su material genético, lo que hace que el ciclo de vida de estos virus sea único.
Esta separación del material genómico del resto del contenido celular encerrándolo es un tipo de compartimento diferente a todo lo que se había visto en la naturaleza, dicen los expertos.
Según el artículo, por lo general, los fagos inyectan su material genético en la bacteria donde flota libremente en la sustancia viscosa interna de la célula (citoplasma) mientras el virus secuestra el equipo de la bacteria para replicarse.
Pero estos fagos gigantes construyen un compartimento de separación alrededor de su ADN poco después de que ingresa a su huésped, un poco como nuestras células tienen un núcleo para proteger nuestro ADN, impidiendo que el sistema inmunitario de la bacteria y otras enzimas defensivas interfieran con el ADN viral.
Los científicos utilizaron microscopía crioelectrónica y tomografía para examinar este compartimento hasta la escala atómica. La cubierta protectora se construyó a partir de un solo tipo de proteína, que los investigadores llamaron chimallin, en honor a un antiguo escudo azteca.
La terapia con fagos ya se está utilizando para tratar con éxito a pacientes con infecciones por superbacterias. También se está considerando para personalizar nuestros microbiomas cuando se descontrolan.
Con estas molestas cepas de bacterias que se niegan a morir, se espera que maten a 10 millones de personas anualmente para 2050. Entonces, cualquier pista que podamos obtener del enemigo de nuestro enemigo para defendernos mejor, no puede llegar lo suficientemente pronto, finaliza la nota de Science Alert.

por David | Jun 3, 2022 | BIOMEDICO
Las enfermedades neurodegenerativas tienden a generar una gran discapacidad física, intelectual y social. Según la Organización Mundial de la Salud (OMS), actualmente 50 millones de personas sufren demencia en todo el mundo y se espera que dicha cifra se triplique para 2050. Con estos datos sobre la mesa, no es de extrañar que uno de los retos actuales de la medicina sea paliar los efectos de estas patologías.
Ahora, una investigación conjunta de los laboratorios dirigidos por Silvia de Santis y Santiago Canals, científicos del Instituto de Neurociencias de Alicante (CSIC-UMH), ha permitido visualizar por primera vez y con gran detalle la inflamación cerebral utilizando la resonancia magnética ponderada por difusión (dw-MRI)
Esta detallada radiografía no puede obtenerse mediante una resonancia convencional, sino que son necesarias secuencias de adquisición de datos y modelos matemáticos especiales. Así, los investigadores han podido cuantificar las alteraciones en la morfología de las diferentes poblaciones de células implicadas en el proceso inflamatorio cerebral.
Los resultados demuestran que la nueva técnica puede detectar de forma no invasiva y diferenciada la activación de la microglía y los astrocitos, dos tipos de células cerebrales implicadas en la neuroinflamación.
Dicho avance, publicado en la revista Science Advances, podría ser clave para cambiar el rumbo del estudio y tratamiento de enfermedades neurodegenerativas como el alzhéimer, el párkinson y la esclerosis múltiple.
Los inconvenientes de la técnica actual
En general, hay una carencia de enfoques no invasivos capaces de caracterizar específicamente la inflamación cerebral in vivo. El estándar actual es la tomografía por emisión de positrones (PET), pero es difícil de generalizar y se asocia con la exposición a la radiación ionizante. En consecuencia, su uso está limitado en poblaciones vulnerables y en estudios longitudinales.
Otro inconveniente de la PET es su baja resolución espacial, ya que esto la hace inadecuada para obtener imágenes de estructuras pequeñas. Además, los radiotrazadores específicos de la inflamación se expresan en múltiples tipos de células (microglía, astrocitos y endotelio), lo que impide diferenciarlas.
Una estrategia innovadora
Frente a estos inconvenientes, la resonancia magnética ponderada por difusión (dw-MRI) puede obtener imágenes de la microestructura cerebral ‘in vivo’ de forma no invasiva y con alta resolución. Esta técnica captura el movimiento aleatorio de las moléculas de agua en el parénquima cerebral para generar contraste en las imágenes de resonancia magnética.
“Es la primera vez que se demuestra que la señal de este tipo de resonancia magnética puede detectar la activación microglial y astrocitaria, con huellas específicas para cada población de células. Esta estrategia refleja los cambios morfológicos validados post mortem por inmunohistoquímica cuantitativa”, señalan los investigadores.
También han demostrado que la dw-MRI es sensible y específica para detectar la inflamación con y sin neurodegeneración, por lo que ambas condiciones pueden ser diferenciadas. Además, permite discriminar entre la inflamación y la desmielinización característica de la esclerosis múltiple.
Este trabajo ha logrado asimismo demostrar el valor traslacional del enfoque utilizado en un grupo de humanos sanos a alta resolución, “en la que realizamos un análisis de reproducibilidad. La asociación significativa con patrones de densidad de microglía conocidos apoya la utilidad del método para generar biomarcadores fiables”, destaca De Santis.
“Creemos que caracterizar aspectos relevantes de la microestructura de los tejidos durante la inflamación puede impactar en nuestra comprensión del estudio de muchas afecciones cerebrales y transformar el diagnóstico y el seguimiento actual del tratamiento”, concluye.
¿Cómo se ha llevado a cabo el estudio?
Para validar el modelo, los investigadores han utilizado un paradigma de inflamación en ratas a través de la administración intracerebral de lipopolisacáridos (LPS). Con ello, se preserva la viabilidad y la morfología neuronal mientras que se induce primero una activación de la microglía y, de manera retardada, una respuesta de los astrocitos.
Esta secuencia temporal de eventos celulares permite que las respuestas gliales puedan ser disociadas transitoriamente de la degeneración neuronal, y la firma de la microglía reactiva investigada independientemente de la astrogliosis.
Para aislar la huella de la activación astrocitaria, los investigadores repitieron el experimento tratando previamente a los animales con un inhibidor que anula temporalmente alrededor del 90 % de la microglía. Posteriormente, con un paradigma establecido de daño neuronal, comprobaron si el modelo era capaz de desentrañar las huellas neuroinflamatorias con y sin una neurodegeneración concomitante.
“Esto es fundamental para demostrar la utilidad de nuestro enfoque como plataforma para el descubrimiento de biomarcadores del estado inflamatorio en las enfermedades neurodegenerativas, donde tanto la activación de la glía como el daño neuronal son actores clave”, aclaran.
Por último, los investigadores utilizaron un paradigma establecido de desmielinización, basado en la administración focal de lisolecitina, para demostrar que los biomarcadores desarrollados no reflejan las alteraciones del tejido que se encuentran frecuentemente en los trastornos cerebrales.
Fuente: https://invdes.com.mx/salud/una-resonancia-magnetica-permite-ver-la-inflamacion-del-cerebro-in-vivo-por-primera-vez/






