
por David | Dic 10, 2021 | BIOMEDICO
Combinando conocimientos de química, física, biología e ingeniería, unos científicos han desarrollado un biomaterial lo suficientemente resistente como para reparar con él corazones, músculos y cuerdas vocales. Este logro representa un importante avance en la medicina regenerativa.
Las personas que se recuperan de una lesión cardíaca suelen enfrentarse a un proceso largo y complicado, sin garantías de que llegue a buen puerto. La curación es un desafío debido al constante movimiento que deben soportar los tejidos cuando el corazón late. Algo parecido ocurre con las cuerdas vocales. Hasta ahora no existía ningún material inyectable lo bastante robusto para permitir una curación plena de estas lesiones.
Ahora, si los futuros ensayos clínicos tienen buen resultado, sí se dispondrá de un material capaz de afrontar con éxito esos retos.
El trabajo es obra de un equipo que incluye, entre otros, a Guangyu Bao, Luc Mongeau y Jianyu Li, los tres de la Universidad McGill en Canadá.
El producto desarrollado por los investigadores es un hidrogel inyectable. El hidrogel es un tipo de biomaterial que proporciona espacio, a modo de andamio, para que las células vivan y crezcan. Una vez inyectado en el cuerpo, el biomaterial forma una estructura estable y porosa (el “andamio”) que permite a las células vivas crecer allí e incluso cruzar a otra parte, para reparar entre todas ellas los órganos lesionados.
Los científicos probaron la durabilidad de su hidrogel en una máquina que desarrollaron para simular la biomecánica extrema de las cuerdas vocales humanas. Al vibrar a 120 veces por segundo durante más de 6 millones de ciclos, el nuevo biomaterial permaneció intacto mientras que otros hidrogeles estándar se fracturaron en pedazos, incapaces de soportar la tensión estructural.
Bao y sus colegas exponen los detalles técnicos del nuevo material en la revista académica Advanced Science, bajo el título “Injectable, pore-forming, perfusable double-network hydrogels resilient to extreme biomechanical stimulations”.
Referencias:
– https://noticiasdelaciencia.com/art/43225/tejido-sintetico-capaz-de-reparar-corazones

por David | Dic 3, 2021 | BIOMEDICO, Sin categoría, SOCIAL
La pandemia de covid-19 nos colocó en enero de 2020 sobre una montaña rusa de miedos, esperanzas, desesperaciones y euforias de la que aún no nos hemos bajado.
Hay momentos en que todos pensamos que la pandemia ya es cosa del pasado, y otros en que parece que comenzamos de nuevo desde cero. El último susto nos lo ha dado la nueva variante ómicron.
Quizá recapitular y enumerar las incertidumbres que nos quedan aún respecto al virus SARS-CoV-2 y su eliminación nos ayude a enfrentar los meses venideros.
1. ¿Va a volverse el virus endémico?
Pues estamos empezando a pensar que no. Primero, por lo que nos enseña la historia. Las dos pandemias semejantes a esta que hemos sufrido (viruela y poliomielitis) sólo se consiguieron atajar a base de medidas de contención y vacunación masiva, y llevó muchos años. En el caso de la viruela fueron varios siglos, y conllevó la invención de las vacunas. Y la polio, descrita por primera vez en 1840, todavía no está erradicada, puesto que aún se notifican casos en dos países del mundo. Con lo que va camino de los dos siglos.
Ninguno de estos dos virus se ha convertido en endémico: ha habido que erradicarlos y ha llevado mucho tiempo. Cada vez está más claro que lo mismo puede pasar con SARS-CoV-2.
En segundo lugar, no es un virus inocuo como un catarro. La infección por SARS-CoV-2 es un síndrome respiratorio, inicialmente similar a una gripe (y en muchos casos lo es). Pero ahora sabemos que también puede dejar secuelas que permanecen durante meses. Más adelante sabremos cuánto y en qué medida exactamente, pero muchas personas están sufriendo las consecuencias de la infección. Además, si desagregamos los datos totales de afectados por covid persistente, la balanza se inclina hacia las mujeres.
2. ¿Debemos dejar que circule a su antojo?
Hace meses, algunos barajaron esa posibilidad, pero las evidencias demuestran que no era buena idea. No hasta que sepamos más sobre las secuelas. Nos preocupan especialmente los niños, que tienen toda la vida por delante y podrían padecerlas de forma crónica.
La situación en España es mejor con respecto a otros países de nuestro entorno gracias a la gran aceptación de las vacunas y al mantenimiento de medidas como mascarillas en interiores. Pero el aumento de los casos en las últimas semanas indica que la tónica de algunos países europeos de rescatar medidas que se habían abandonado nos llegará a nosotros. Basta observar la rapidez con que se han cancelado en toda Europa los vuelos con Sudáfrica al aparecer una nueva variante de preocupación. Y no debemos olvidar que la nueva variante ha aparecido en un país con bajos niveles de vacunación donde el virus, básicamente, campa a su antojo.
3. ¿Qué pasa? ¿No funcionan las vacunas?
Sí funcionan, pero aún no tenemos vacunas esterilizantes (es decir, que impidan la transmisión). Además, nuestro sistema inmunitario, con las vacunas actuales, no es una pared blindada. Casi lo es cuando nos acabamos de vacunar, pero cuando pasa un tiempo y descienden los anticuerpos en sangre, podemos contagiarnos y el virus se divide en nuestras mucosas.
Lleva un tiempo desplegar la respuesta inmune, y durante ese tiempo podemos transmitirlo. En menor medida que los no vacunados, pero lo transmitimos. No acabaremos en el hospital ni moriremos, pero durante el tiempo que transcurre hasta que nos deshacemos del virus, podemos contagiar.
Los estudios preclínicos y clínicos de las vacunas publicados confirman que los virus se replican en personas vacunadas. Es decir, no eliminan la transmisión del virus.
¿Eso ocurre con todas las vacunas? Con las que han llegado antes y están aprobadas, sí. La disminuyen mucho, pero la protección que nos otorgan no elimina el virus totalmente. Nos protegen de la enfermedad grave, como se demuestra, afortunadamente, por el descenso acusado de fallecimientos, pero no son completas.
Es un factor muy importante que, de momento, permite al virus moverse a sus anchas, reproducirse y evolucionar hacia variantes más contagiosas, como ha ocurrido hasta ahora.
La buena noticia es que la investigación en vacunas continúa, y a estas vacunas de primera generación seguirán otras que, además de adaptarse a nuevas variantes o ser más completas en el reconocimiento del virus, conseguirán doblegarlo y eliminarlo. Probablemente deberemos revacunarnos hasta que lleguen, para que las defensas no disminuyan. Y, cuando lleguen, para erradicar la enfermedad.
Algunas de estas vacunas se administrarán de forma nasal u oral, desarrollando defensas en las vías respiratorias altas para atajar el problema desde el minuto uno del contagio.
4. ¿Qué va a pasar?
Seguiremos teniendo oleadas. Ya menos letales, pero el virus seguirá cebándose con los vulnerables (por no estar vacunados o por no tener una respuesta inmune adecuada). Y seguirá propagándose hasta que nos inmunicen a todos con una vacuna esterilizante. Pensamos que el virus no se va a endemizar, sino que tendremos que aplastarlo por varias vías, como hicimos con viruela y polio.
A no ser que surja una variante que produzca enfermedad muy leve (tipo catarro), sin secuelas, muy transmisible y que desplace a todas las demás. Otros coronavirus lo han hecho. En ese caso, el virus se instalaría conviviendo entre nosotros y produciendo un catarro más de los que ya circulan.
Por lo que sabemos hasta ahora, la nueva variante Ómicron podría ser de este tipo. Si lo es, estupendo. Si no, no pasa nada: seguiremos ajustando nuestras incertidumbres. Es así como se trabaja en ciencia.
Referencias:
– https://www.bbc.com/mundo/noticias-59477692
– https://theconversation.com/covid-19-la-pandemia-de-las-incertidumbres-172642

por David | Nov 26, 2021 | BIOMEDICO
Científicos han conseguido, mediante un implante personalizado, aliviar la depresión severa de una mujer que no respondía a ningún otro tratamiento.
Un equipo de investigadores de la Universidad de California en San Francisco (EE. UU.) han conseguido, mediante un implante cerebral personalizado, aliviar los aplastantes síntomas de la depresión severa de una mujer, Sarah, de 36 años de edad, permitiéndole ver una vez más la belleza del mundo y de la vida. «Es como si mi lente sobre el mundo hubiera cambiado», dijo Sarah, la paciente voluntaria que solicitó ser identificada solo por su nombre de pila.
Sarah llevaba con depresión severa varios años.
Los científicos implantaron electrodos de alambre delgado temporales en su cerebro. Estos electrodos permitieron a los investigadores monitorear la actividad cerebral correspondiente a los síntomas de depresión de Sarah, un patrón que los investigadores podrían usar como biomarcador. En el caso de esta paciente, surgió un signo en particular: una onda cerebral rápida llamada onda gamma en su amígdala, una estructura cerebral que se sabe que está involucrada en las emociones.
Estimulación cerebral profunda
Así que le prepararon un dispositivo a medida: el implante fue construido específicamente para el cerebro de Sarah. Basándose en estimulación cerebral profunda, el procedimiento utiliza la comunicación eléctrica entre dos componentes implantados en el cuerpo: un electrodo con varios puntos de contacto, implantado en el cerebro, y un generador de impulsos programable, implantado en algún lugar debajo de la piel. Mediante ensayo y error, los científicos identificaron un área cerebral estrechamente conectada, el estriado ventral, donde una pequeña dosis de electricidad parecía tener un impacto inmediato y profundo.
Los electrodos implantados en su cerebro, enviaron impulsos eléctricos a otras estructuras implantadas, casi como «un marcapasos para el cerebro». La estimulación de alta frecuencia en el área objetivo del cerebro hizo que se bloquearan las señales que causaban los síntomas de la depresión.
Tras el tratamiento, la mujer mostró una «mejora rápida y sostenida» en la gravedad de la depresión, explican los investigadores en su estudio publicado en la revista Nature Medicine.
«Se requiere trabajo futuro para determinar si los resultados y el enfoque de este estudio de paciente único se generalizan a una población más amplia», aclara la neurocientífica de UCSF Katherine Scangos, quien dirigió el estudio.
El dispositivo cuesta alrededor de 35.000 dólares (unos 30.000 euros) y es una versión adaptada de uno que se usa normalmente para tratar la epilepsia, llamado NeuroPace RNS System. El enfoque utilizado por los investigadores requirió una gran cantidad de tecnología sofisticada de imágenes y aprendizaje automático.
Aunque la terapia se ha probado en un solo paciente, y solo sería adecuada para aquellos con una enfermedad grave, el éxito se considera enormemente significativo. Gracias a este avance, la depresión pronto podría tratarse simplemente mediante un implante cerebral, a tenor de los exitosos resultados de este pionero experimento y también poder ofrecer un tratamiento personalizado para todos aquellos trastornos neurosiquiátricos difíciles de tratar.
Según la Organización Mundial de la Salud (OMS), más de 264 millones de personas en todo el mundo padecen TDM y otros 20 millones padecen esquizofrenia. Ambos se encuentran entre los precursores más comunes del suicidio.
Por el momento, los investigadores ya han inscrito a dos pacientes más y esperan reclutar a nueve más para evaluar si la técnica se puede aplicar de forma más masiva.
Referencia:
– https://www.muyinteresante.es/salud/articulo/un-implante-cerebral-logra-eliminar-la-depresion-141633420181
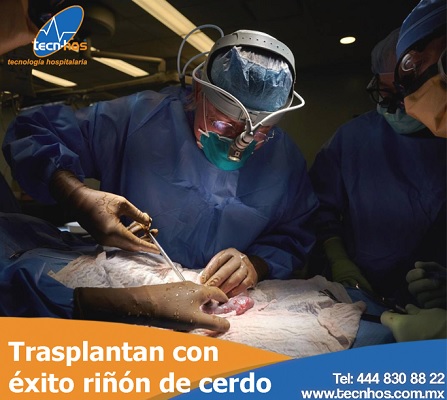
por David | Oct 22, 2021 | BIOMEDICO
Se trata de una operación histórica que aporta un paso más para que la utilización de órganos animales en humanos sea una realidad
Un equipo quirúrgico dirigido por el doctor Robert Montgomery en las instalaciones de Longone Health de la Universidad de Nueva York (EE. UU.) ha trasplantado con éxito un riñón de cerdo a un receptor humano. Es el primer caso en el que un riñón ha sido trasplantado de un organismo diferente, científicamente conocido como xenotrasplante, y no ha sido rechazado por el sistema inmunológico del huésped, ya que el riñón ha funcionado como se suponía: filtrando desechos y produciendo orina sin mayores consecuencias. Esta exitosa demostración ofrece un rayo de esperanza a cientos de miles de personas en el mundo que actualmente se encuentran en eternas listas de espera para trasplantes de órganos.
¿Cómo ha sido el proceso?
El trasplante implicó el uso de un cerdo cuyos genes habían sido alterados de modo que sus tejidos ya no contenían una molécula conocida por desencadenar un rechazo casi inmediato. La receptora era una paciente estadounidense con muerte cerebral con signos de disfunción renal, cuya familia aceptó el experimento antes de que le quitaran el soporte vital, dijeron los investigadores.
Primero, el nuevo riñón de cerdo se adhirió a sus vasos sanguíneos y se mantuvo fuera del cuerpo, permitiendo que los investigadores pudieran tener acceso a él y no solo monitorizarlo.
El riñón produjo «la cantidad de orina que cabría esperar» de un riñón humano trasplantado, dicen los expertos, y no hubo evidencia del rechazo temprano y vigoroso que se observa cuando los riñones de cerdo no modificados se trasplantan a primates no humanos.
Un paso significativo
Los científicos llevan trabajando durante décadas sobre la posibilidad de usar órganos de animales para trasplantes, pero se han visto obstaculizados por el gran problema de cómo prevenir el rechazo inmediato por parte del cuerpo humano.
El equipo planteó la hipótesis de que eliminar el gen del cerdo de un carbohidrato que desencadena el rechazo, una molécula de azúcar o glicano, llamada alfa-galactosa, evitaría el problema. El cuerpo humano ataca y finalmente rechaza el trasplante cuando el sistema inmune humano detecta esta sustancia extraña, así que implantaron un embrión de cerdo con un gen modificado dentro de una cerda sustituta y esta dio a luz un lechón con sistema inmunológico modificado. Una vez adulto, el cerdo también se sometió a una cirugía para unir su timo a su riñón. El timo es una pequeña glándula cerca de la parte superior de los pulmones, que produce glóbulos blancos. Luego, los cirujanos unieron el órgano al muslo del receptor humano. No hubo rechazo.
Aún no se han publicado datos científicos sobre el trasplante y será necesario una evaluación técnica antes de que pueda considerarse un éxito total. Pero es un gran paso.
Los cerdos tienen órganos similares a los humanos, con la ventaja de que también son comparables en tamaño a los nuestros, y se crían regularmente para el consumo de carne, lo que significa que es menos probable que planteen preocupaciones éticas entre el público que, por ejemplo, los órganos extraídos de otros primates. Y la necesidad de órganos para trasplantes es cada vez mayor en nuestra sociedad.
Referencias:
– https://www.muyinteresante.es/salud/articulo/trasplantan-con-exito-un-rinon-de-cerdo-en-una-mujer-con-muerte-cerebral-481634802338
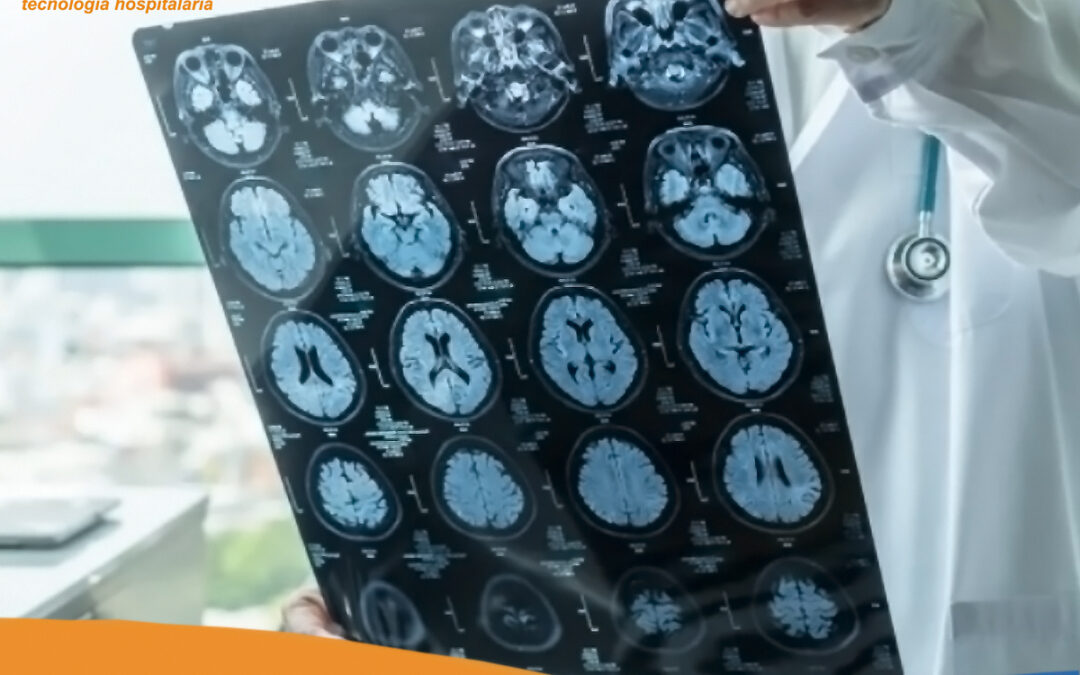
por David | Sep 23, 2021 | BIOMEDICO
El sistema de inteligencia artificial desarrollado, analiza escáneres cerebrales para llegar a su diagnóstico.
Esta nueva IA puede identificar los primeros marcadores de la enfermedad de Alzheimer con más del 99% de precisión. Al evaluar los escáneres cerebrales de los adultos mayores, el algoritmo puede detectar cambios sutiles que suelen tener lugar antes del diagnóstico, lo que permite a los médicos ofrecer un tratamiento temprano a las personas de alto riesgo.
Así, la IA reconoce con éxito los signos de deterioro cognitivo leve que, por lo general, no produce síntomas perceptibles, y está asociado con cambios en ciertas regiones del cerebro que se pueden detectar en las exploraciones de imágenes de resonancia magnética funcional (fMRI). Sin embargo, los médicos no siempre los identifican al mirar directamente estos escáneres.
Los investigadores reutilizaron una red neuronal existente llamada ResNet18 y crearon un modelo de IA capaz de identificar estos pormenores con mayor confiabilidad. La IA fue entrenada con 51.443 escáneres cerebrales de 138 personas. Luego, se utilizaron otras 27.310 imágenes para validar el algoritmo, que pudo identificar el deterioro cognitivo temprano con una precisión del 99,99% y el MCI tardío con una precisión del 99,95%.
«El procesamiento de señales moderno permite delegar el procesamiento de imágenes a la máquina, lo que puede completarlo con la suficiente rapidez y precisión», explicó el autor del estudio, Rytis Maskeliūnas, en su estudio publicado en la revista Diagnostics. «Por supuesto, no nos atrevemos a sugerir que un profesional médico deba confiar en un algoritmo al cien por cien».
«El modelo propuesto funcionó mejor que otros modelos conocidos en términos de precisión, sensibilidad y especificidad», escriben los autores, y añaden que su sistema es «más confiable y preciso» que las herramientas de diagnóstico existentes para el riesgo futuro del alzhéimer.
Referencias:
– https://www.muyinteresante.es/tecnologia/inteligencia-artificial/articulo/crean-una-ia-que-predice-el-riesgo-alzheimer-con-un-99-99-de-precision-971631181325
– https://doi.org/10.3390/diagnostics11061071

por David | Ago 6, 2021 | BIOMEDICO
La urgencia de recordar una experiencia peligrosa requiere que el cerebro realice una serie de movimientos potencialmente peligrosos: las neuronas y otras células cerebrales «abren» su ADN en numerosos lugares, más de lo que se pensaba anteriormente, para proporcionar un acceso rápido a las instrucciones genéticas, para los mecanismos de almacenamiento de memoria.
El alcance de estas roturas de doble cadena del ADN (DSB) en múltiples regiones cerebrales clave es sorprendente y preocupante, explica la autora principal del estudio, Li-Huei Tsai, profesora de neurociencia del MIT y directora del Instituto Picower para el aprendizaje y la memoria, porque mientras las roturas se reparan de forma rutinaria, ese proceso puede volverse más defectuoso y frágil con la edad. El laboratorio de Tsai ha demostrado que estas roturas persistentes están asociados con la neurodegeneración y el deterioro cognitivo, y los mecanismos de reparación pueden fallar.
«Queríamos comprender exactamente qué tan extendida y extensa está esta actividad natural en el cerebro después de la formación de la memoria porque eso puede darnos una idea de cómo la inestabilidad genómica podría socavar la salud del cerebro en el futuro», dice Tsai, quien también es profesora en el Departamento de Ciencias Cognitivas y Cerebrales y líder de la iniciativa Aging Brain Initiative del MIT. «Claramente, la formación de la memoria es una prioridad urgente para la función cerebral saludable, pero estos nuevos resultados que muestran que varios tipos de células cerebrales rompen su ADN en tantos lugares para expresar genes rápidamente son todavía sorprendentes».
Rastreo de pausas
En 2015, el laboratorio de Tsai proporcionó la primera demostración de que la actividad neuronal causaba DSB y que inducían una rápida expresión génica. Pero esos hallazgos, en su mayoría hechos en preparaciones de laboratorio de neuronas, no capturaron el alcance completo de la actividad en el contexto de la formación de la memoria en un animal que se comporta, y no investigaron lo que sucedió en células distintas de las neuronas.
En el nuevo estudio, publicado el 1 de julio en PLOS ONE, el autor principal y ex estudiante de posgrado Ryan Stott, y el coautor y ex técnico de investigación Oleg Kritsky, buscaron investigar el panorama completo de la actividad de DSB en el aprendizaje y la memoria. Para ello, le dieron a los ratones pequeños golpes eléctricos en sus patas cuando entraban en una caja, para condicionar un recuerdo de miedo de ese contexto. Luego utilizaron varios métodos para evaluar los DSB y la expresión génica en sus cerebros durante la siguiente media hora, particularmente entre una variedad de tipos de células en la corteza prefrontal y el hipocampo, dos regiones esenciales para la formación y almacenamiento de recuerdos de miedo condicionados. También realizaron mediciones en los cerebros de ratones que no experimentaron el choque en sus patras para establecer una línea de base de actividad de comparación.
La creación de una memoria de miedo duplicó el número de DSB entre las neuronas del hipocampo y la corteza prefrontal, afectando a más de 300 genes en cada región. Muchos se asociaron con la función de las conexiones que hacen las neuronas entre sí, llamada sinapsis. Esto tiene sentido porque el aprendizaje surge cuando las neuronas cambian sus conexiones (un fenómeno llamado “plasticidad sináptica”) y los recuerdos se forman cuando grupos de neuronas se conectan en conjuntos llamados engramas. «Muchos genes esenciales para la función neuronal y la formación de la memoria, y significativamente más de lo esperado en base a observaciones previas en neuronas cultivadas … son potencialmente puntos críticos de formación de DSB», escriben los autores en el estudio.
En otro análisis, los investigadores confirmaron a través de mediciones de ARN que el aumento de los DSB se correlacionó estrechamente con el aumento de la transcripción y expresión de los genes afectados, incluidos los que afectan la función de la sinapsis, tan rápido como 10-30 minutos después de la exposición al choque en la pata del roedor. “En general, encontramos que los cambios transcripcionales están más fuertemente asociados con [los DSB] en el cerebro de lo anticipado”, escribieron. «Anteriormente, observamos 20 loci asociados a genes [DSB] después de la estimulación de neuronas cultivadas, mientras que en el hipocampo y la corteza prefrontal vemos más de 100-150 loci asociados a genes [DSB] que son inducidos transcripcionalmente».
Rompiendo con estrés
En el análisis de la expresión génica, los neurocientíficos observaron no solo las neuronas sino también las células cerebrales no neuronales, o glía, y descubrieron que también mostraban cambios en la expresión de cientos de genes después del condicionamiento del miedo. Se sabe que los astrocitos llamados glía están involucrados en el aprendizaje del miedo, por ejemplo, y mostraron cambios significativos en la expresión genética y DSB después del condicionamiento del miedo.
Entre las funciones más importantes de los genes asociados con los DSB relacionados con el condicionamiento del miedo en la glía se encontraba la respuesta a las hormonas. Por lo tanto, los investigadores buscaron qué hormonas podrían estar particularmente involucradas y descubrieron que se trataba de glutocortocoides que se secretan en respuesta al estrés. Efectivamente, los datos del estudio mostraron que en la glía, muchos de los DSB que ocurrieron después del condicionamiento del miedo ocurrieron en sitios genómicos relacionados con los receptores glutocortocoides. Otras pruebas revelaron que la estimulación directa de esos receptores hormonales podría desencadenar los mismos DSB que hizo el condicionamiento del miedo y que el bloqueo de los receptores podría prevenir la transcripción de genes clave después del condicionamiento del miedo.
Tsai dice que el hallazgo de que las glías están tan profundamente involucradas en el establecimiento de recuerdos a partir del condicionamiento del miedo es una sorpresa importante del nuevo estudio. “La capacidad de la glía para montar una respuesta transcripcional robusta a los glutocorticoides sugiere que puede tener un papel más importante que desempeñar en la respuesta al estrés y su impacto en el cerebro durante el aprendizaje de lo que se pensaba anteriormente”, escribieron ella y sus coautores.
¿Daño y peligro?
Será necesario realizar más investigaciones para demostrar que los DSB necesarios para formar y almacenar recuerdos de miedo son una amenaza para la salud cerebral posterior, pero el nuevo estudio se suma a la evidencia de que puede ser el caso, dicen los autores. “En general, hemos identificado sitios de DSB en genes importantes para las funciones neuronales y gliales, lo que sugiere que la reparación deficiente del ADN de estas roturas recurrentes del ADN que se generan como parte de la actividad cerebral podría resultar en inestabilidad genómica que contribuye al envejecimiento y enfermedades en el cerebro», escribieron
Referencias:
https://news.mit.edu/2021/memory-making-involves-extensive-dna-breaking-0714






